Sắt (II) Clorua (FeCl₂), hay còn gọi là Iron(II) Chloride hoặc Ferrous Chloride, là một hợp chất vô cơ có tính khử mạnh. Hóa chất này thường tồn tại dưới dạng tinh thể màu xanh lá nhạt hoặc dung dịch FeCl₂ 20%, FeCl₂ 25%, FeCl₂ 30% tùy theo nồng độ. Nhờ đặc tính hóa học độc đáo, sắt (II) clorua được sử dụng rộng rãi trong xử lý nước thải, xi mạ kim loại, sản xuất giấy, ngành dệt nhuộm và nhiều ứng dụng công nghiệp khác.
- Công thức hóa học: FeCl₂ (Iron Dichloride)
- Số CAS: 7758-94-3
- Dạng tồn tại: Tinh thể xanh lá nhạt hoặc dung dịch FeCl₂ 20%, FeCl₂ 25%, FeCl₂ 30%
- Tính tan: Hòa tan tốt trong nước, tạo dung dịch có tính axit nhẹ
- Tính oxy hóa: Khi tiếp xúc với không khí, iron(II) chloride có thể chuyển thành sắt (III) clorua (FeCl₃)
Lưu ý: FeCl₂ có tính hút ẩm mạnh, cần bảo quản kín để tránh oxy hóa và giảm hiệu quả trong quá trình sử dụng.

Tính Chất Hóa Học Của FeCl₂
Sắt (II) Clorua (FeCl₂) là một muối của sắt với clorua, có tính chất hóa học đặc trưng của ion Fe²⁺ và ion Cl⁻. Dưới đây là một số tính chất hóa học quan trọng của FeCl₂, giúp phân biệt nó với các hợp chất sắt khác:
- FeCl₂ có tính khử mạnh, dễ bị oxy hóa thành FeCl₃ khi tiếp xúc với không khí.
- Hòa tan tốt trong nước và tạo phức với nhiều chất khác như CN⁻, SO₄²⁻, NO₃⁻.
- Phản ứng với bazơ tạo kết tủa Fe(OH)₂ trắng xanh, nhưng nhanh chóng chuyển thành Fe(OH)₃ nâu đỏ khi có oxy.
- Có thể dùng làm chất khử trong các phản ứng với bạc nitrat hoặc các hợp chất oxy hóa khác.
- Dễ phản ứng với axit mạnh để tạo thành muối sắt khác như FeSO₄ hoặc Fe(NO₃)₃.
Các tính chất hóa học phổ biến của hóa chất FeCL2
- Khả Năng Tan Trong Nước và Môi Trường Khác
- FeCl₂ là một muối tan mạnh trong nước, tạo thành dung dịch màu xanh lá nhạt.
- Khi hòa tan trong nước, FeCl₂ phân ly hoàn toàn theo phương trình: FeCl2→Fe2++2Cl−
- Trong dung dịch, ion Fe²⁺ có thể tạo phức với các anion khác như SO₄²⁻, NO₃⁻, PO₄³⁻, tùy vào điều kiện môi trường.
- FeCl₂ cũng tan trong các dung môi hữu cơ phân cực như methanol và ethanol, nhưng không tan trong dung môi không phân cực như benzen hay toluene.
- Khả Năng Bị Oxy Hóa Thành FeCl₃
- FeCl₂ dễ bị oxy hóa khi tiếp xúc với không khí hoặc các tác nhân oxy hóa mạnh, chuyển thành FeCl₃ (Sắt (III) Clorua).
- Phương trình phản ứng khi FeCl₂ tiếp xúc với oxy trong môi trường ẩm: 4FeCl2+O2+4HCl→4FeCl3+2H2O
- Lưu ý: Quá trình oxy hóa này có thể làm giảm hiệu quả của FeCl₂ trong các ứng dụng xử lý nước nếu không được bảo quản đúng cách.
- Tính Khử Trong Các Phản Ứng Hóa Học
- FeCl₂ có tính khử mạnh, có thể khử các ion kim loại có hóa trị cao hơn về dạng kim loại tự do hoặc hóa trị thấp hơn. Ví dụ: FeCl2+Cl2→FeCl3 (Sắt (II) Clorua bị oxy hóa bởi Clo để tạo thành Sắt (III) Clorua)
- FeCl₂ cũng có thể khử các ion bạc trong dung dịch bạc nitrat để tạo ra bạc kim loại: FeCl2+2AgNO3→Fe(NO3)2+2Ag↓ (Sắt (II) khử ion Ag⁺ thành bạc kim loại lắng xuống)
- Phản Ứng Với Bazơ Để Tạo Hydroxit Sắt (II)
- Khi FeCl₂ phản ứng với dung dịch kiềm như NaOH, KOH, hoặc NH₄OH, sẽ tạo ra kết tủa sắt (II) hydroxit Fe(OH)₂ màu trắng xanh: FeCl2+2NaOH→Fe(OH)2↓+2NaCl
- Fe(OH)₂ có tính không bền, dễ bị oxy hóa trong không khí thành Fe(OH)₃, có màu nâu đỏ. 4Fe(OH)2+O2+2H2O→4Fe(OH)3
- Phản Ứng Với Axit Mạnh Để Tạo Thành Muối Sắt Khác
- FeCl₂ có thể phản ứng với axit mạnh như HCl, H₂SO₄, tạo ra các muối sắt (II) khác:
- Với axit sulfuric: FeCl2+H2SO4→FeSO4+2HCl
- Với axit nitric (HNO₃), FeCl₂ có thể bị oxy hóa thành Fe(NO₃)₃: FeCl2+2HNO3→Fe(NO3)3+NO2+H2O
- FeCl₂ có thể phản ứng với axit mạnh như HCl, H₂SO₄, tạo ra các muối sắt (II) khác:
- Khả Năng Hình Thành Phức Chất
- Trong dung dịch, ion Fe²⁺ từ FeCl₂ có thể tạo phức với các ligand như CN⁻, NH₃, EDTA, hoặc các anion hữu cơ, tạo ra nhiều loại hợp chất khác nhau, tùy vào điều kiện môi trường.
- Ví dụ:
- Fe²⁺ + 6CN⁻ → [Fe(CN)₆]⁴⁻ (Phức Ferrocyanide màu vàng nhạt)
- Fe²⁺ + EDTA → [Fe(EDTA)]²⁻ (Phức bền giúp FeCl₂ ít bị oxy hóa hơn trong dung dịch)
Ứng dụng của FeCl₂ trong công nghiệp
- Xử lý nước thải công nghiệp: Nên dùng FeCl₂ 20% hoặc 25%, vì có khả năng keo tụ tốt mà không gây ảnh hưởng lớn đến pH.
- Xi mạ kim loại & tẩy gỉ: Nên dùng FeCl₂ 30%, vì có khả năng oxy hóa mạnh hơn, giúp loại bỏ gỉ sét hiệu quả.
- Ngành giấy & bột giấy: Dùng FeCl₂ 20%, giúp loại bỏ lignin và tạp chất hữu cơ tốt hơn.
- Ngành dệt nhuộm: Dùng FeCl₂ 25%, giúp cố định màu nhuộm tốt hơn mà không gây ảnh hưởng đến chất lượng vải.
Xử lý nước thải công nghiệp & đô thị
Theo thống kê năm 2023, khoảng 70% FeCl₂ được sử dụng trong xử lý nước thải công nghiệp & đô thị, 20% trong xi mạ kim loại, 10% trong ngành giấy & dệt nhuộm.
- Giảm phosphate: FeCl₂ phản ứng với phosphate trong nước, giúp ngăn chặn hiện tượng phú dưỡng & ô nhiễm nguồn nước, đảm bảo nước thải đạt tiêu chuẩn xả thải.
- Loại bỏ kim loại nặng: FeCl₂ kết tủa hiệu quả chì (Pb), cadmium (Cd), đồng (Cu), thủy ngân (Hg), kẽm (Zn), giúp giảm nguy cơ ô nhiễm nước ngầm.
- Giảm BOD/COD: Với tính oxy hóa mạnh, FeCl₂ tăng hiệu suất xử lý sinh học, giúp cải thiện chất lượng nước đầu ra, đáp ứng QCVN 40:2011/BTNMT.
Lưu ý: Khi mua FeCl₂ 20%, FeCl₂ 25%, FeCl₂ 30%, cần đảm bảo hàm lượng sắt (II) clorua phù hợp với yêu cầu xử lý nước thải.

Việc sử dụng FeCl₂ trong xử lý nước thải đặc biệt phổ biến trong các ngành:
- Dệt nhuộm: Giảm màu sắc và hợp chất hữu cơ từ thuốc nhuộm.
- Xi mạ kim loại: Xử lý nước thải chứa ion kim loại nặng từ các nhà máy xi mạ.
- Thực phẩm & đồ uống: Loại bỏ tạp chất hữu cơ từ nước thải chế biến thực phẩm.
Sử dụng trong ngành công nghiệp giấy & bột giấy
Trong sản xuất giấy, FeCl₂ được sử dụng để làm sạch nước quá trình và loại bỏ các hợp chất gây ô nhiễm. Đặc biệt, FeCl₂ giúp:
- Loại bỏ màu từ nước thải chứa lignin và các hợp chất hữu cơ.
- Hỗ trợ quá trình tái chế giấy bằng cách tách mực in hiệu quả.
- Ổn định pH và giảm hàm lượng cặn bẩn trong nước tái sử dụng.
Công nghiệp xi mạ & sản xuất kim loại
FeCl₂ được sử dụng như một chất tẩy gỉ và xử lý bề mặt kim loại trước khi xi mạ hoặc hàn. Nó giúp loại bỏ oxit kim loại, cải thiện độ bám dính của lớp phủ mạ và bảo vệ bề mặt khỏi quá trình oxy hóa. Ứng dụng cụ thể:
- Tẩy rỉ sét trên sắt thép trước khi sơn phủ hoặc mạ kẽm.
- Làm sạch bề mặt nhôm & đồng trong sản xuất linh kiện điện tử.
Ngành công nghiệp hóa chất & sản xuất hợp chất sắt khác
FeCl₂ là nguyên liệu để sản xuất các hợp chất sắt khác như:
- Sắt (III) Clorua (FeCl₃) – chất keo tụ mạnh hơn FeCl₂ trong xử lý nước.
- Sắt oxit từ tính (Fe₃O₄) – ứng dụng trong vật liệu từ tính và công nghệ nano.
Ngoài ra, FeCl₂ còn được dùng trong tổng hợp chất xúc tác và sản xuất một số loại thuốc trừ sâu, phân bón.
Ứng Dụng FeCl₂ Trong Ngành Dệt Nhuộm
Vai trò của FeCl₂ trong quá trình nhuộm vải
- Tác nhân cố định màu (Mordant):
- FeCl₂ giúp gắn kết các phân tử thuốc nhuộm với sợi vải, cải thiện độ bám màu.
- Đặc biệt quan trọng trong nhuộm vải tự nhiên như cotton, len, và lụa.
- Cải thiện độ bền màu:
- Vải nhuộm với FeCl₂ có độ bền màu cao hơn dưới tác động của ánh sáng, nước, và giặt tẩy.
- Giúp duy trì màu sắc ổn định hơn theo thời gian.
- Giảm nhu cầu sử dụng thuốc nhuộm:
- FeCl₂ có thể thay đổi độ pH của dung dịch nhuộm, giúp tối ưu hóa sự hấp thụ màu.
- Giảm lượng thuốc nhuộm cần sử dụng, từ đó tiết kiệm chi phí cho doanh nghiệp dệt may.
- Ứng dụng trong xử lý nước thải dệt nhuộm:
- Nước thải từ ngành dệt nhuộm thường chứa thuốc nhuộm dư thừa và hợp chất hữu cơ khó phân hủy.
- FeCl₂ giúp kết tủa và loại bỏ các thành phần này, giảm màu sắc và nồng độ COD/BOD trong nước thải.

So sánh FeCl₂ với các tác nhân cố định màu khác
| Chất cố định màu | Hiệu quả cố định màu | Khả năng bám màu | Chi phí |
|---|---|---|---|
| FeCl₂ | Trung bình – Cao | Cao | Thấp |
| FeCl₃ | Cao | Cao | Cao |
| Al₂(SO₄)₃ (Phèn nhôm) | Trung bình | Trung bình | Trung bình |
👉 Tại sao FeCl₂ được ưa chuộng hơn FeCl₃?
- Chi phí thấp hơn FeCl₃.
- Ít gây ăn mòn thiết bị hơn do có tính acid nhẹ hơn FeCl₃.
- Dễ bảo quản và vận chuyển hơn vì ít hút ẩm hơn FeCl₃.
Thông số kỹ thuật & Quy cách sản phẩm
| Thông số | FeCl₂ 20% | FeCl₂ 25% | FeCl₂ 30% |
|---|---|---|---|
| Màu sắc | Xanh nhạt | Xanh lá | Xanh đậm |
| Tỷ lệ FeCl₂ (%) | 20 ± 1% | 25 ± 1% | 30 ± 1% |
| pH (dung dịch 1%) | 3.5 – 4.5 | 3.0 – 4.0 | 2.0 – 3.0 |
| Ứng dụng phổ biến | Xử lý nước thải công nghiệp, dệt nhuộm | Xi mạ, tẩy gỉ kim loại | Xử lý nước cấp, sản xuất hợp chất sắt |
📌 Bảng so sánh FeCl₂ với FeCl₃, PAC, phèn nhôm trong xử lý nước:
| Chất keo tụ | Hiệu quả xử lý nước | Ảnh hưởng pH | Độ tan | Chi phí |
|---|---|---|---|---|
| FeCl₂ | Tốt (kim loại nặng, phosphate) | Ít ảnh hưởng | Cao | Thấp |
| FeCl₃ | Rất tốt (mạnh hơn FeCl₂) | Giảm pH mạnh | Cao | Cao |
| PAC | Trung bình (chủ yếu loại bỏ cặn) | Ít ảnh hưởng | Cao | Trung bình |
| Phèn nhôm | Yếu hơn (hiệu quả kém với kim loại nặng) | Giảm pH | Trung bình | Thấp |
📌 🔹 Lựa chọn FeCl₂ khi nào?
- Khi cần loại bỏ kim loại nặng, phosphate mà không ảnh hưởng đến pH nước.
- Khi doanh nghiệp muốn tiết kiệm chi phí hơn so với FeCl₃ hoặc PAC.
Lợi ích khi sử dụng FeCl₂ so với FeCl₃ và PAC trong xử lý nước:
- Tiết kiệm chi phí: FeCl₂ có giá thành thấp hơn FeCl₃ và PAC.
- Hiệu quả cao trong keo tụ & loại bỏ kim loại nặng: FeCl₂ phản ứng nhanh hơn, ít tạo cặn hơn so với phèn nhôm.
- Ít ảnh hưởng đến pH nước: Không làm thay đổi pH quá nhiều, giúp tiết kiệm hóa chất điều chỉnh pH.
- Thích hợp cho nhiều loại nước thải khác nhau: Đặc biệt hiệu quả với nước thải có hàm lượng kim loại nặng cao.
Phương Pháp Điều Chế FeCl₂ Bằng Điện Phân
Ngoài phương pháp tổng hợp FeCl₂ từ sắt và axit HCl, phương pháp điện phân cũng được sử dụng trong công nghiệp để sản xuất FeCl₂ tinh khiết.
Phương trình điện phân FeCl₂:
Quá trình điện phân có thể diễn ra theo hai cách:
- Điện phân dung dịch FeCl₃ để thu FeCl₂
- Phương trình phản ứng: FeCl3+e−→FeCl2+Cl−
- Điều kiện:
- Dung dịch FeCl₃ làm chất điện ly.
- Sử dụng điện cực than chì hoặc titan phủ oxit.
- Dòng điện một chiều.

- Điện phân dung dịch FeSO₄ trong môi trường HCl
- Phương trình phản ứng: FeSO4+2HCl→FeCl2+H2SO4
- Ưu điểm:
- Phương pháp này giúp tạo ra FeCl₂ có độ tinh khiết cao.
- Ít tạp chất hơn so với phương pháp hòa tan sắt trong axit HCl.
- Điện phân FeCl₃ hoặc FeSO₄ trong môi trường HCl
- Ưu điểm: Độ tinh khiết cao, ít tạp chất.
- Nhược điểm: Cần dòng điện liên tục, chi phí cao hơn.
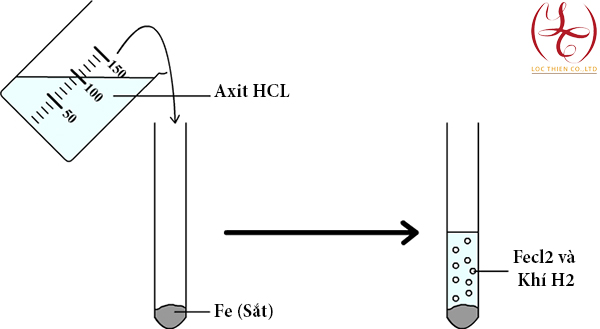
- Phản ứng trực tiếp giữa Fe + HCl
- Phương trình: Fe + 2HCl → FeCl₂ + H₂↑
- Ưu điểm: Dễ thực hiện, không cần nguồn điện.
- Nhược điểm: Dung dịch có thể chứa tạp chất, cần tinh chế trước khi sử dụng.
- Phương trình: Fe + 2HCl → FeCl₂ + H₂↑
📌 Lựa chọn phương pháp sản xuất FeCl₂ phù hợp:
- Sản xuất quy mô công nghiệp: Nên dùng phương pháp điện phân để đảm bảo chất lượng.
- Ứng dụng trong xử lý nước: Phản ứng trực tiếp Fe + HCl có thể dùng để tạo FeCl₂ tại chỗ với chi phí thấp hơn.
Ứng dụng phương pháp điện phân:
- Được sử dụng trong công nghiệp sản xuất FeCl₂ quy mô lớn với độ tinh khiết cao.
- Đảm bảo nguồn cung ổn định cho xử lý nước thải, xi mạ, công nghiệp hóa chất.
Lưu trữ & An toàn sử dụng FeCl₂
Hướng dẫn lưu trữ
Hướng dẫn bảo quản và an toàn sử dụng FeCl₂:
- Bảo quản: Giữ iron(II) chloride trong thùng kín, nhựa HDPE hoặc thùng poly để hạn chế quá trình oxy hóa thành FeCl₃.
- Tránh tiếp xúc với không khí: FeCl₂ hút ẩm mạnh, dễ bị oxy hóa khi tiếp xúc với độ ẩm.
- Không để gần chất oxy hóa mạnh như axit nitric, thuốc tím, hydrogen peroxide để tránh phản ứng nguy hiểm.
- Lưu trữ ở nơi khô ráo, thoáng mát, tránh nhiệt độ cao để bảo vệ chất lượng FeCl₂.
Khi sử dụng sắt (II) clorua, cần trang bị găng tay, kính bảo hộ và khẩu trang để đảm bảo an toàn.
Biện pháp an toàn khi sử dụng
- Tiếp xúc với da: Nếu FeCl₂ bắn vào da, rửa ngay với nước sạch trong ít nhất 15 phút.
- Tiếp xúc với mắt: Dùng nước sạch hoặc dung dịch NaCl 0.9% để rửa mắt ngay lập tức.
- Hít phải khí FeCl₂: Di chuyển đến nơi thoáng khí, nếu có triệu chứng khó thở, cần tìm sự hỗ trợ y tế.
- Nuốt phải: Không gây nôn, uống nhiều nước và tìm kiếm sự can thiệp y tế ngay lập tức.

Vì sao chọn Lộc Thiên làm nhà cung cấp FeCl₂?
- Giá cả cạnh tranh nhất thị trường:
- Lộc Thiên nhập khẩu trực tiếp & phân phối, đảm bảo giá tốt so với thị trường.
- Hỗ trợ kỹ thuật 24/7:
- Đội ngũ chuyên gia tư vấn cách sử dụng FeCl₂ tối ưu, giúp doanh nghiệp tiết kiệm chi phí vận hành.
- Hướng dẫn tính toán liều lượng FeCl₂ chính xác cho từng ứng dụng (xử lý nước, xi mạ, dệt nhuộm).
- Chính sách đổi trả linh hoạt:
- Cam kết hoàn tiền 100% hoặc đổi mới miễn phí nếu sản phẩm không đạt chất lượng cam kết.
- Giao hàng nhanh toàn quốc với hệ thống kho bãi tại TP.HCM, Bình Dương, Đồng Nai, Đà Nẵng.
Sắt (II) Clorua (FeCl₂) là một hóa chất công nghiệp quan trọng với nhiều ứng dụng đa dạng trong xử lý nước, sản xuất giấy, xi mạ kim loại và ngành hóa chất. Việc chọn nguồn cung cấp uy tín sẽ giúp doanh nghiệp đảm bảo chất lượng sản phẩm và tối ưu hóa chi phí sản xuất. Lộc Thiên cam kết cung cấp FeCl₂ đạt chuẩn, giá cạnh tranh, và dịch vụ hậu mãi tốt nhất cho khách hàng B2B.
FAQ – Câu hỏi thường gặp về FeCL2
- FeCl₂ có thể bị ảnh hưởng bởi nhiệt độ và độ ẩm như thế nào trong quá trình bảo quản?
- Sắt (II) Clorua (FeCl₂) rất nhạy cảm với độ ẩm và nhiệt độ cao. Nếu tiếp xúc lâu với không khí, nó hấp thụ độ ẩm và bị oxy hóa thành FeCl₃, làm giảm hiệu quả ứng dụng trong công nghiệp.
- Nhiệt độ cao (>40°C): Tăng tốc quá trình oxy hóa FeCl₂, gây kết tủa Fe(OH)₂ khi tiếp xúc với hơi nước.
- Độ ẩm cao (>70%): FeCl₂ hút ẩm mạnh, dễ tạo thành FeCl₂·xH₂O, làm thay đổi tỷ lệ thành phần khi sử dụng.
- Giải pháp bảo quản:
- Lưu trữ trong thùng kín, túi chống ẩm, hoặc bọc khí trơ (N₂, Ar) nếu bảo quản lâu dài.
- Tránh để trong khu vực có hơi nước, ánh sáng trực tiếp hoặc gần nguồn nhiệt.
- Sắt (II) Clorua (FeCl₂) rất nhạy cảm với độ ẩm và nhiệt độ cao. Nếu tiếp xúc lâu với không khí, nó hấp thụ độ ẩm và bị oxy hóa thành FeCl₃, làm giảm hiệu quả ứng dụng trong công nghiệp.
- FeCl₂ có thể thay thế hoàn toàn FeCl₃ trong xử lý nước không?
- Mặc dù FeCl₂ và FeCl₃ đều được dùng làm chất keo tụ trong xử lý nước, nhưng chúng không hoàn toàn thay thế nhau vì có tính chất khác biệt:
- FeCl₂:
- Ưu điểm: Hiệu quả xử lý kim loại nặng cao, ít ảnh hưởng đến pH nước.
- Nhược điểm: Hoạt tính oxy hóa yếu hơn FeCl₃, cần thời gian phản ứng dài hơn.
- FeCl₃:
- Ưu điểm: Keo tụ mạnh hơn FeCl₂, xử lý nước nhanh hơn.
- Nhược điểm: Giảm pH nước mạnh, có thể cần thêm hóa chất trung hòa.
- FeCl₂:
- Khi nào nên dùng FeCl₂ thay thế FeCl₃?
- ✅ Khi xử lý nước thải chứa kim loại nặng mà không cần thay đổi pH nhiều.
- ✅ Khi cần tiết kiệm chi phí, vì FeCl₂ có giá rẻ hơn FeCl₃.
- ❌ Không nên thay thế hoàn toàn nếu cần keo tụ nhanh & xử lý màu sắc nước hiệu quả hơn.
- Mặc dù FeCl₂ và FeCl₃ đều được dùng làm chất keo tụ trong xử lý nước, nhưng chúng không hoàn toàn thay thế nhau vì có tính chất khác biệt:
- FeCl₂ có an toàn khi sử dụng trong ngành thực phẩm và dược phẩm không?
- FeCl₂ KHÔNG được sử dụng trực tiếp trong ngành thực phẩm & dược phẩm vì:
- Có thể chứa tạp chất kim loại nặng nếu không được tinh chế đặc biệt.
- Tính acid nhẹ, có thể gây ăn mòn thiết bị chế biến thực phẩm nếu không kiểm soát tốt.
- Tính oxy hóa thấp, không phù hợp để bảo quản thực phẩm.
- Có thể chứa tạp chất kim loại nặng nếu không được tinh chế đặc biệt.
- Ngoại lệ:
- FeCl₂ có thể được sử dụng trong dược phẩm nhưng dưới dạng muối tinh khiết FeCl₂ cấp thực phẩm (Food Grade) hoặc cấp dược phẩm (Pharmaceutical Grade), thường dùng để bổ sung sắt trong thuốc trị thiếu máu.
- FeCl₂ KHÔNG được sử dụng trực tiếp trong ngành thực phẩm & dược phẩm vì:
- FeCl₂ có tương thích với hệ thống ống dẫn & thiết bị kim loại trong công nghiệp không?
- FeCl₂ có tác động đáng kể đến các thiết bị kim loại, đặc biệt là ống dẫn, bể chứa, hệ thống bơm:
- Thép carbon & gang: FeCl₂ có thể gây ăn mòn, đặc biệt trong điều kiện có oxy & độ ẩm cao.
- Thép không gỉ (inox 304, 316): Ít bị ảnh hưởng nhưng có thể bị ăn mòn điểm nếu nồng độ FeCl₂ quá cao.
- Nhôm & hợp kim đồng: Không tương thích, vì FeCl₂ có thể phản ứng mạnh, gây ăn mòn nhanh.
- 🛡 Cách giảm ăn mòn thiết bị khi sử dụng FeCl₂:
- Dùng hệ thống ống HDPE, nhựa PVC, FRP thay vì kim loại.
- Nếu phải dùng thép, nên phủ lớp bảo vệ epoxy hoặc lớp chống ăn mòn.
- Điều chỉnh pH dung dịch FeCl₂ từ 3.0 – 4.5 để giảm tính ăn mòn.
- FeCl₂ có tác động đáng kể đến các thiết bị kim loại, đặc biệt là ống dẫn, bể chứa, hệ thống bơm:
- FeCl₂ có thể tái chế hoặc xử lý an toàn khi không sử dụng hết không?
- FeCl₂ có thể tái chế hoặc xử lý an toàn, nhưng cần tuân thủ các biện pháp phù hợp:
- Tái chế FeCl₂:
- Nếu FeCl₂ chưa bị oxy hóa hoàn toàn thành FeCl₃, có thể tái chế bằng cách loại bỏ tạp chất & điều chỉnh nồng độ.
- Một số nhà máy tái sử dụng FeCl₂ trong xử lý nước thải, giảm chi phí mua mới.
- Xử lý FeCl₂ không sử dụng hết:
- Không được đổ trực tiếp vào hệ thống thoát nước do có thể gây ô nhiễm.
- Trung hòa FeCl₂ bằng NaOH hoặc Ca(OH)₂ để tạo kết tủa Fe(OH)₂, sau đó xử lý bùn lắng theo tiêu chuẩn môi trường.
- Nếu FeCl₂ có hàm lượng kim loại nặng cao, cần xử lý theo quy định QCVN 07:2009/BTNMT về chất thải nguy hại.
- Tái chế FeCl₂:
- FeCl₂ có thể tái chế hoặc xử lý an toàn, nhưng cần tuân thủ các biện pháp phù hợp:















